
Struttura, proprietà, sintesi e usi dell'acetato di isoamile
Il acetato di isoamile è un estere la cui formula molecolare è CH3COO (CHDue)DueCH (CH3)Due. A temperatura ambiente è costituito da un liquido oleoso, limpido, incolore, infiammabile e volatile. In effetti, è un estere troppo volatile e profumato.
La sua caratteristica principale è quella di emanare un odore che contribuisce all'aroma di molti frutti, soprattutto quelli di banana. Allo stesso modo, quest'ultimo frutto costituisce una delle sue fonti naturali per eccellenza..

Da qui il nome di olio di banana che viene dato a una soluzione di isoamil acetato, oppure a una miscela di isomil acetato con nitrocellulosa. Il composto è ampiamente utilizzato come aromatizzante per alimenti, gelati e caramelle.
Inoltre, viene utilizzato nella produzione di fragranze con usi diversi. È anche un solvente utilizzato nell'estrazione di metalli e composti organici come l'acido acetico..
L'isoamil acetato è il risultato dell'esterificazione dell'alcool isoamilico con acido acetico. Nei laboratori didattici di chimica organica, questa sintesi rappresenta un'esperienza interessante per implementare l'esterificazione, inondando il laboratorio con fragranza di banana.
Indice articolo
- 1 Struttura di isoamil acetato
- 1.1 Interazioni intermolecolari
- 1.2 Fragranza alla banana
- 2 Proprietà
- 2.1 Nomi chimici
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Descrizione fisica
- 2.5 Odore
- 2.6 Aroma
- 2.7 Punto di ebollizione
- 2.8 Punto di fusione
- 2.9 Punto di infiammabilità
- 2.10 Solubilità in acqua
- 2.11 Solubilità in solventi organici
- 2.12 Densità
- 2.13 Densità del vapore
- 2.14 Pressione di vapore
- 2.15 Temperatura di autoaccensione
- 2.16 Viscosità
- 2.17 Calore di combustione
- 2.18 Soglia di odore
- 2.19 Indice di rifrazione
- 2.20 Velocità di evaporazione relativa
- 2.21 Costante dielettrica
- 2.22 Archiviazione
- 3 Sintesi
- 4 Usi
- 4.1 Aromi per alimenti e bevande
- 4.2 Solvente e diluente
- 4.3 Fragranze
- 4.4 Altri
- 5 Rischi
- 6 Riferimenti
Struttura dell'isoamil acetato
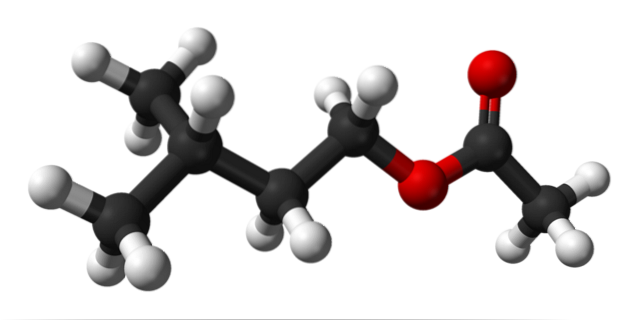
L'immagine in alto mostra la struttura molecolare dell'acetato di isoamile utilizzando un modello di sfere e barre. Le sfere rosse corrispondono agli atomi di ossigeno, in particolare a quelli che identificano questo composto come estere; la sua porzione eterea, R-O-R, e il gruppo carbonile, C = O, avente quindi la formula di struttura R'COOR.
A sinistra, R', abbiamo il radicale isopentilico alchilico, (CH3)DueCHCHDueCHDue; ea destra, R, al gruppo metile, a cui si deve l '"acetato" del nome di questo estere. È un estere relativamente piccolo, in grado di interagire con i recettori chimici dell'olfatto nel nostro naso, provocando segnali che il cervello interpreta come fragranza.
Interazioni intermolecolari
La stessa molecola di isoamil acetato è flessibile; ma il radicale isopentile non beneficia delle interazioni intermolecolari perché è ramificato, impedendo stericamente agli atomi di ossigeno di interagire in modo efficiente attraverso le forze dipolo-dipolo.
Inoltre, questi due ossigeno non possono accettare legami idrogeno; strutturalmente la molecola non ha modo di donarli. Contrariamente ai dipoli interrotti, l'acetato di isoamile può interagire in modo intermolecolare per mezzo delle forze di dispersione di Londra; che sono direttamente proporzionali alla loro massa molecolare.
Pertanto, è la massa molecolare dell'estere che è responsabile delle sue molecole che formano un liquido con un alto punto di ebollizione (141 ° C). Allo stesso modo, è responsabile della sua fusione solida a una temperatura di -78 ° C.
Fragranza alla banana
Le sue forze intermolecolari sono così deboli che il liquido è abbastanza volatile da permeare l'ambiente circostante con gli odori di banana. È interessante notare che l'odore dolce di questo estere può cambiare se il numero di atomi di carbonio viene ridotto o aumentato..
Vale a dire, se invece di avere sei atomi di carbonio alifatici ne avesse cinque (con il radicale isobutilico) il suo odore somiglierebbe a quello dei lamponi; se il radicale fosse secbutile, l'odore sarebbe carico di tracce di solventi organici; e se avesse più di sei atomi di carbonio, l'odore inizierebbe a diventare saponoso e metallico.
Proprietà
Nomi chimici
-Acetato di isoamile
-Etanoato di isopentile
-Acetato di 3-metilbutile
-Acetato di isopentile
-Olio di banana o piantaggine.
Formula molecolare
C7H14ODue o CH3COO (CHDue)DueCH (CH3)Due
Peso molecolare
130,187 g / mol.
Descrizione fisica
È un liquido oleoso, limpido e incolore.
Odore
A temperatura ambiente ha un profumo intenso e gradevole di banana.
Gusto
Ha un sapore simile a quello della pera e della mela.
Punto di ebollizione
124,5 ºC.
Punto di fusione
-78,5 ºC.
punto di accensione
Tazza chiusa 92ºF (33ºC); tazza aperta 100ºF (38ºC).
Solubilità dell'acqua
2.000 mg / L a 25 ºC.
Solubilità in solventi organici
Miscibile con alcool, etere, acetato di etile e alcol amilico.
Densità
0,876 g / cm3.
Densità del vapore
4.49 (relativo all'aria = 1).
Pressione del vapore
5,6 mmHg a 25 ºC.
Temperatura di autoaccensione
680 ºF (360 ºC).
Viscosità
-1,03 c Rumore a 8,97 ° C
-0,872 c Rumore a 19,91 ° C.
Calore di combustione
8.000 cal / g.
Soglia di odore
Aria = 0,025 µL / L
Acqua = 0,017 mg / L.
Indice di rifrazione
1.400 a 20 ºC.
Tasso di evaporazione relativo
0,42 (relativo all'acetato di butile = 1).
Costante dialettrica
4,72 a 20 ºC.
Conservazione
L'isoamil acetato è un composto volatile e infiammabile. Pertanto, deve essere conservato al freddo in contenitori completamente ermetici, lontano da sostanze combustibili..
Sintesi
È prodotto dall'esterificazione dell'alcool isoamilico con acido acetico glaciale, in un processo noto come esterificazione di Fisher. L'acido solforico è comunemente usato come catalizzatore, ma l'acido p-toluensolfonico catalizza anche la reazione:
(CH3)DueCH-CHDue-CHDueCHDueOH + CH3COOH => CH3COOCHDue-CHDue-CHDue-CH (CH3)Due
Applicazioni
Aromi per alimenti e bevande
Viene utilizzato per conferire un sapore di pera in acqua e negli sciroppi. Viene utilizzato in Cina per preparare aromi di frutta, come fragola, mora, ananas, pera, mela, uva e banana. Le dosi utilizzate sono: 190 mg / kg in pasticceria; 120 mg / kg in pasticceria; 56 mg / kg nel gelato; e 28 mg / kg nelle bevande analcoliche.
Solvente e diluente
È un solvente per:
-Nitrocellulosa e celluloide
-Vernici impermeabili
-Gomma estere
-Resina vinilica
-Resina di cumarone e olio di ricino.
Viene utilizzato come solvente per la determinazione del cromo e viene utilizzato come agente di estrazione per ferro, cobalto e nichel. Viene anche usato come solvente per colori ad olio e vecchie lacche. Inoltre, viene utilizzato nella produzione di smalti per unghie.
Questo estere è usato come diluente nella produzione di acido acetico. Il petrolio è utilizzato come materia prima in un processo di ossidazione che produce una soluzione acquosa di acido acetico e altri composti, come l'acido formico e l'acido propionico..
Come solvente e vettore per altre sostanze, è stato utilizzato nei primi giorni dell'industria aeronautica per proteggere i tessuti delle ali degli aerei..
Fragranze
-È usato come deodorante per ambienti per coprire i cattivi odori.
-È usato come profumo nella lacca delle scarpe.
-Per testare l'efficienza delle maschere antigas, poiché l'acetato di isoamile ha una soglia di odore molto bassa e non è molto tossico.
-È utilizzato nella produzione di fragranze come Cipro; l'osmanto profumato; il giacinto; e dal forte sapore orientale, essendo usato a basse dosi, meno dell'1%.
Altri
Viene utilizzato nella produzione di seta e perle artificiali, pellicole fotografiche, vernici impermeabili e bronzer. Viene anche utilizzato nell'industria tessile in tintoria e finissaggio. Viene utilizzato nel lavaggio a secco di articoli di abbigliamento e mobili in stoffa.
Inoltre, l'isoamil acetato viene utilizzato nella produzione di rayon, un tessuto sintetico; nell'estrazione della penicillina e come sostanza standard in cromatografia.
Rischi
L'acetato di isoamile può irritare la pelle e gli occhi al contatto fisico. L'inalazione può causare irritazione al naso, alla gola e ai polmoni. Nel frattempo, l'esposizione ad alte concentrazioni può causare mal di testa, sonnolenza, vertigini, vertigini, affaticamento e svenimento..
Il contatto prolungato con la pelle può farla diventare secca e screpolata..
Riferimenti
- Bilbrey Jenna. (30 luglio 2014). Acetato di isoamile. Chemistry World della Royal Society of Chemistry. Estratto da: chemistryworld.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acetato di isoamile. Database PubChem. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Acetato di isoamile. Estratto da: en.wikipedia.org
- Royal Society of Chemistry. (2015). Acetato di isoamile. Chemspider. Estratto da: chemspider.com
- Dipartimento della salute e dei servizi per anziani del New Jersey. (2005). Acetato di isoamile. [PDF]. Estratto da: nj.gov
- Libro chimico. (2017). Acetato di isoamile. Estratto da: chemicalbook.com


Nessun utente ha ancora commentato questo articolo.