
Come calcolare l'assorbività molare e gli esercizi risolti
Il assorbimento molare è una proprietà chimica che indica quanta luce una specie può assorbire in soluzione. Questo concetto è molto importante nell'analisi spettroscopica dell'assorbimento della radiazione fotonica con energie nel campo dell'ultravioletto e del visibile (UV-vis)..
Poiché la luce è composta da fotoni con proprie energie (o lunghezze d'onda), a seconda della specie o della miscela analizzata, un fotone può essere assorbito in misura maggiore di un altro; cioè, la luce viene assorbita a determinate lunghezze d'onda caratteristiche della sostanza.

Pertanto, il valore di assorbimento molare è direttamente proporzionale al grado di assorbimento della luce a una data lunghezza d'onda. Se la specie assorbe poca luce rossa, il suo valore di assorbimento sarà basso; mentre se c'è un forte assorbimento della luce rossa, l'assorbività avrà un valore elevato.
Una specie che assorbe la luce rossa rifletterà un colore verde. Se il colore verde è molto intenso e scuro, significa che c'è un forte assorbimento della luce rossa.
Tuttavia, alcune tonalità di verde possono essere dovute ai riflessi di diverse gamme di gialli e blu, che vengono mescolati e percepiti come turchese, smeraldo, vetro, ecc..
Indice articolo
- 1 Che cos'è l'assorbibilità molare?
- 1.1 Unità
- 2 Come calcolarlo?
- 2.1 Gioco diretto
- 2.2 Metodo di rappresentazione grafica
- 3 esercizi risolti
- 3.1 Esercizio 1
- 3.2 Esercizio 2
- 4 Riferimenti
Cos'è l'assorbività molare?
L'assorbività molare è anche nota con le seguenti designazioni: estinzione specifica, coefficiente di attenuazione molare, assorbimento specifico o coefficiente di Bunsen; È stato persino chiamato in altri modi, quindi è stato fonte di confusione.
Ma cos'è esattamente l'assorbibilità molare? È una costante definita nell'espressione matematica della legge di Lamber-Beer, e indica semplicemente quanto la specie chimica o la miscela assorbe la luce. Tale equazione è:
A = εbc
Dove A è l'assorbanza della soluzione ad una lunghezza d'onda selezionata λ; b è la lunghezza della cella in cui è contenuto il campione da analizzare e quindi è la distanza che la luce attraversa all'interno della soluzione; c è la concentrazione delle specie assorbenti; e ε, l'assorbività molare.
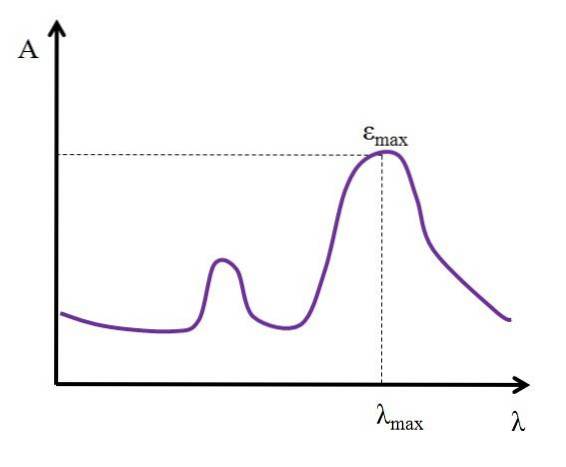
Dato λ, espresso in nanometri, il valore di ε rimane costante; ma quando si cambiano i valori di λ, cioè quando si misurano assorbanze con luci di altre energie, ε cambia, raggiungendo un valore minimo o massimo.
Se il suo valore massimo è noto, εmax, è determinato allo stesso tempo λmax; cioè la luce che la specie assorbe di più:
Unità
Quali sono le unità di ε? Per trovarli, bisogna sapere che le assorbanze sono valori adimensionali; e quindi, la moltiplicazione delle unità di bec deve annullarsi.
La concentrazione della specie assorbente può essere espressa in g / L o mol / L, eb è solitamente espressa in cm om (perché è la lunghezza della cella attraversata dal fascio di luce). La molarità è uguale a mol / L, quindi c è anche espresso come M.
Quindi, moltiplicando le unità di bec, otteniamo: M ∙ cm. Quali unità deve quindi avere ε per rendere adimensionale il valore di A? Quelli che moltiplicando M ∙ cm danno un valore di 1 (M ∙ cm x U = 1). Risolvendo per U, otteniamo semplicemente M-1∙ cm-1, che può anche essere scritto come: L ∙ mol-1∙ cm-1.
In effetti, usa le unità M.-1∙ cm-1 o L ∙ mol-1∙ cm-1 accelerare i calcoli per determinare l'assorbività molare. Tuttavia, è anche spesso espresso in unità di mDue/ mol o cmDue/ mol.
Quando espressi con queste unità, alcuni fattori di conversione devono essere utilizzati per modificare le unità di be c.
Come calcolarlo?
Liquidazione diretta
L'assorbività molare può essere calcolata direttamente risolvendola nell'equazione precedente:
ε = A / bc
Se si conoscono la concentrazione delle specie assorbenti, la lunghezza delle cellule e l'assorbanza ottenuta a una lunghezza d'onda, è possibile calcolare ε. Tuttavia, questo modo di calcolarlo restituisce un valore impreciso e inaffidabile.
Metodo di rappresentazione grafica
Se osservi attentamente l'equazione della legge di Lambert-Beer, noterai che sembra l'equazione di una retta (Y = aX + b). Ciò significa che se si tracciano i valori di A sull'asse Y e quelli di c sull'asse X, si deve ottenere una retta che passa per l'origine (0,0). Quindi, A diventerebbe Y, X sarebbe c e a sarebbe uguale a εb.
Pertanto, una volta tracciata la linea, è sufficiente prendere due punti qualsiasi per determinare la pendenza, ovvero a. Fatto ciò, e nota la lunghezza della cella b, è facile risolvere il valore di ε.
A differenza della clearance diretta, il grafico A vs c consente di fare la media delle misurazioni dell'assorbanza e riduce l'errore sperimentale; inoltre, linee infinite possono passare attraverso un unico punto, quindi la distanza diretta non è pratica.
Allo stesso modo, errori sperimentali possono far sì che una linea non passi per due, tre o più punti, quindi viene effettivamente utilizzata la linea ottenuta dopo aver applicato il metodo dei minimi quadrati (una funzione che è già incorporata nelle calcolatrici). Il tutto assumendo un'elevata linearità e quindi il rispetto della legge Lamber-Beer..
Esercizi risolti
Esercizio 1
È noto che una soluzione di un composto organico con una concentrazione di 0,008739 M presentava un'assorbanza di 0,6346, misurata a λ = 500 nm e con una lunghezza della cella di 0,5 cm. Calcola l'assorbività molare del complesso a questa lunghezza d'onda.
Da questi dati, ε può essere risolto direttamente:
ε = 0,6346 / (0,5 cm) (0,008739 M)
145.23 M-1∙ cm-1
Esercizio 2
Le seguenti assorbanze vengono misurate a diverse concentrazioni di un complesso metallico a una lunghezza d'onda di 460 nm e con una cella di 1 cm di lunghezza:
A: 0,03010 0,1033 0,1584 0,3961 0,8093
c: 1,8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Calcola l'assorbività molare del complesso.
Ci sono un totale di cinque punti. Per calcolare ε è necessario rappresentarli graficamente ponendo i valori di A sull'asse Y e le concentrazioni c sull'asse X. Fatto ciò si determina la retta dei minimi quadrati, e con la sua equazione possiamo determinare ε.
In questo caso, tracciando i punti e disegnando la linea con un coefficiente di determinazione RDue 0.9905, la pendenza è 7 ∙ 10-4; cioè εb = 7 ∙ 10-4. Pertanto, con b = 1 cm, ε sarà 1428,57 M-1.cm-1 (1/7 ∙ 10-4).
Riferimenti
- Wikipedia. (2018). Coefficiente di attenuazione molare. Estratto da: en.wikipedia.org
- La scienza ha colpito. (2018). Assorbibilità molare. Estratto da: sciencestruck.com
- Analisi colorimetrica: (legge di Beer o analisi spettrofotometrica). Estratto da: chem.ucla.edu
- Kerner N. (s.f.). Esperimento II - Soluzione di colore, assorbanza e legge di birra. Recupero da: umich.edu
- Day, R. e Underwood, A. Chimica analitica quantitativa (quinto ed.). PEARSON Prentice Hall, p-472.
- Gonzáles M. (17 novembre 2010). Assorbibilità Estratto da: quimica.laguia2000.com



Nessun utente ha ancora commentato questo articolo.